CRYSVITA : Résultats d’efficacité chez les adultes atteints de XLH
Un nombre significativement plus élevé de patients recevant CRYSVITA ont atteint des taux de phosphore sérique moyens supérieurs à la LIN† pendant une période de 24 semaines comparativement à ceux recevant le placebo1,2‡§
Proportion de patients ayant atteint des taux de phosphore sérique moyens supérieurs à la LIN (mesurés au point médian de l’intervalle entre les doses) pendant les 24 semaines de traitement1,2

c.
p < 0,0001††
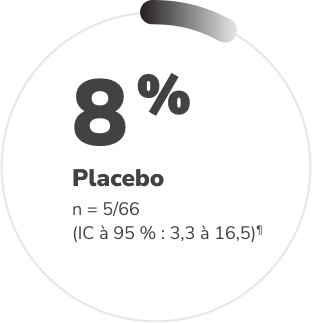
D’après la monographie du produit et Insogna KL et coll., 20181,2.
Chez les patients recevant CRYSVITA, les concentrations moyennes de phosphore sérique restaient égales ou supérieures à la LIN† jusqu’à la semaine 481,3§
Variation du taux de phosphore sérique aux points médians des intervalles entre les doses jusqu’à la semaine 481,3‡‡
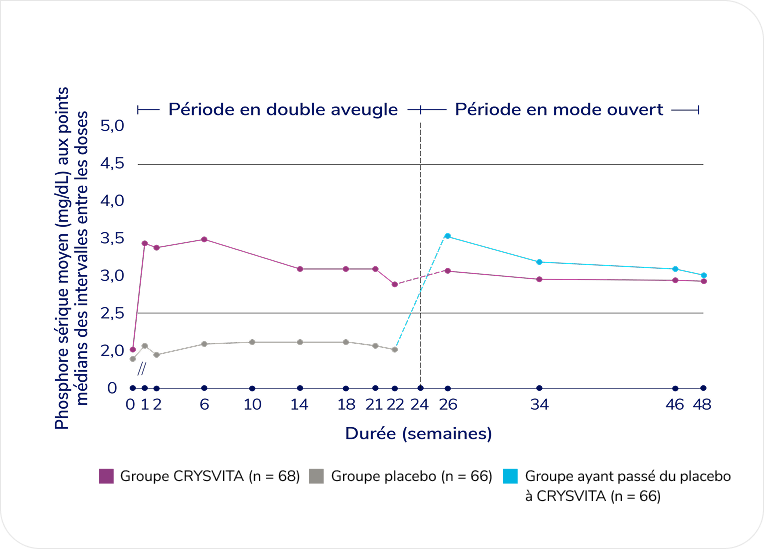
D’après la monographie du produit et Portale AA et coll., 20191,3.
Le groupe placebo est passé à CRYSVITA à la semaine 24.
Notez que 1 mg/dL équivaut à 0,323 mmol/L4.
Les concentrations moyennes de phosphore sérique sont demeurées supérieures à la LIN† jusqu’à la semaine 48 du traitement dans le groupe initial CRYSVITA, et sont demeurées égales ou supérieures à la LIN† chez les patients qui sont passés du placebo à CRYSVITA de la semaine 26 à la semaine 48.1,3
La prise de CRYSVITA a été associée à des améliorations significativement plus importantes des raideurs associées à la XLH comparativement au placebo à la semaine 24 (paramètre d’évaluation secondaire; mesuré en fonction de l’indice WOMAC)1,2§
Raideurs WOMAC – variation de la moyenne des MC entre la valeur obtenue au départ et celle de la semaine 241
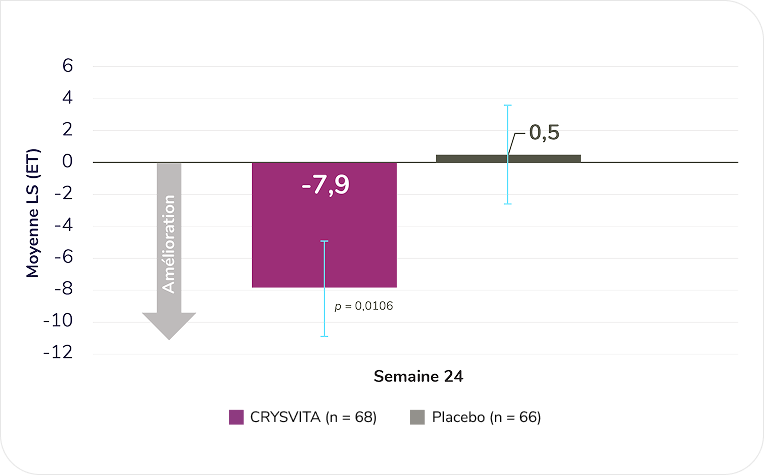
D’après la monographie du produit1.
Les scores moyens (É.-T.) de raideurs WOMAC ont baissé de 64,7 (20,25) à 53,7 (20,76) dans le groupe CRYSVITA et de 61,4 (20,77) à 60,4 (21,83) dans le groupe placebo du départ à la semaine 24 (moyenne des MC [ET] : CRYSVITA -7,9 [3,03] contre placebo 0,5 [3,14], p = 0,0106)1.
Les scores sur chaque domaine de l’indice Western Ontario and McMaster Universities Osteoarthritis (WOMAC) sont normalisés et varient de 0 à 100 avec un score supérieur indiquant un fonctionnement plus faible1.
Comparaison de la guérison des fractures avec CRYSVITA comparativement au placebo (paramètre exploratoire)1-3§
| Fractures actives | Pseudo-fractures actives | Fractures totales | ||||
|---|---|---|---|---|---|---|
| CRYSVITA | Placebo | CRYSVITA | Placebo | CRYSVITA | Placebo | |
| Proportion de fractures guéries à la semaine 24§§ (nombre de fractures guéries/nombre de fractures au départ) | 50,0 % (7/14) |
0 % (0/13) |
41,2 % (21/51) |
9,0 % (7/78) |
43,1 % (28/65) |
7,7 % (7/91) |
| Proportion de fractures guéries à la semaine 24§§ (nombre de fractures guéries/nombre de fractures au départ) | |
| Fractures active | |
| CRYSVITA | 50,0% (7/14) |
| Placebo | 0% (0/13) |
| Pseudo-fractures actives | |
| CRYSVITA | 41,2% (21/51) |
| Placebo | 9,0% (7/78) |
| Fractures totales | |
| CRYSVITA | 43,1% (28/65) |
| Placebo | 7,7% (7/91) |
D’après la monographie du produit1.
Au cours de la période avec étiquetage en clair, où tous les patients ont reçu CRYSVITA1 :
Les patients qui ont continué à recevoir CRYSVITA ont : montré une guérison supplémentaire dans les trois catégories.
Les patients qui ont commencé à recevoir CRYSVITA ont : présenté un taux plus élevé de guérison complète dans les trois catégories comparativement aux patients ayant reçu le placebo.
Les fractures associées à l’ostéomalacie sont définies comme des espaces clairs atraumatiques qui s’étendent sur les cortex osseux et les pseudo-fractures sont comme des espaces clairs atraumatiques qui s’étendent sur un cortex1.
Les fractures ou les pseudo-fractures actives étaient situées principalement dans les fémurs, le tibia/la fibula et les métatarses des pieds1.
Évaluation des effets de CRYSVITA sur l’amélioration de l’ostéomalacie (telle que déterminée par une évaluation histologique et histomorphométrique de biopsies osseuses de la crête iliaque dans le cadre d’une étude ouverte à un seul groupe)1¶¶
Après 48 semaines de traitement, nous avons observé une amélioration histomorphométrique de l’ostéomalacie chez 10 patients comme le démontraient des baisses dans les mesures indirectes.
Volume ostéoïde/volume osseux (OV/BV), n = 11
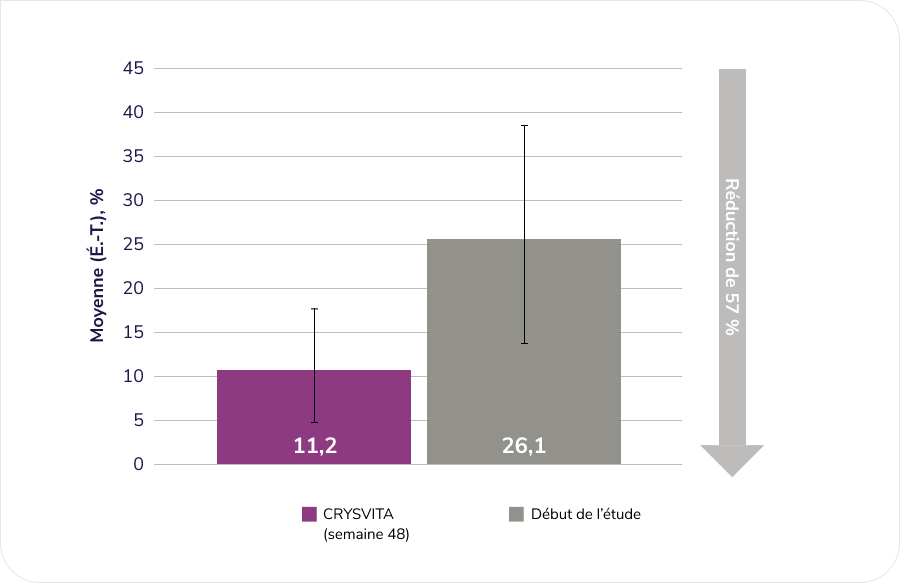
D’après la monographie du produit1.
Épaisseur ostéoïde (O.Th), n = 11
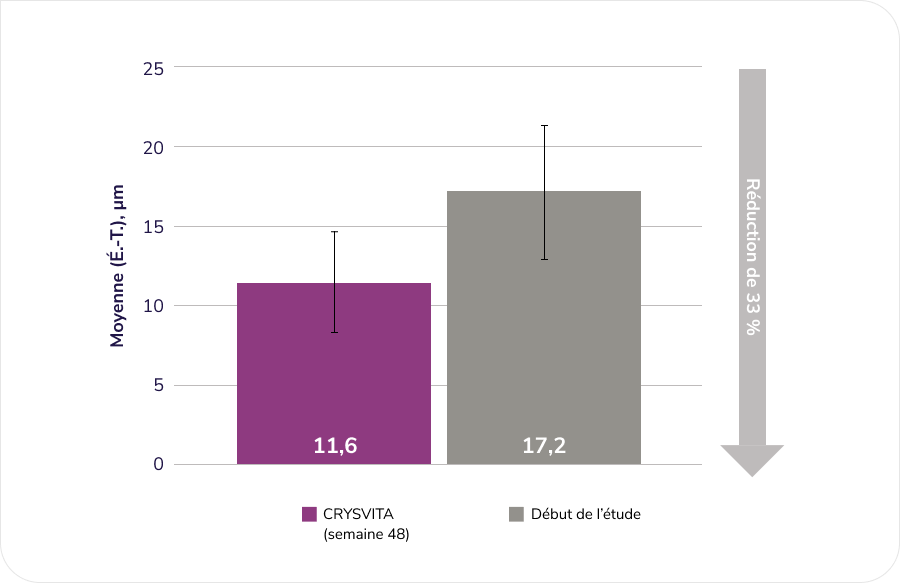
D’après la monographie du produit1.
Délai de minéralisation (MLt), n = 6
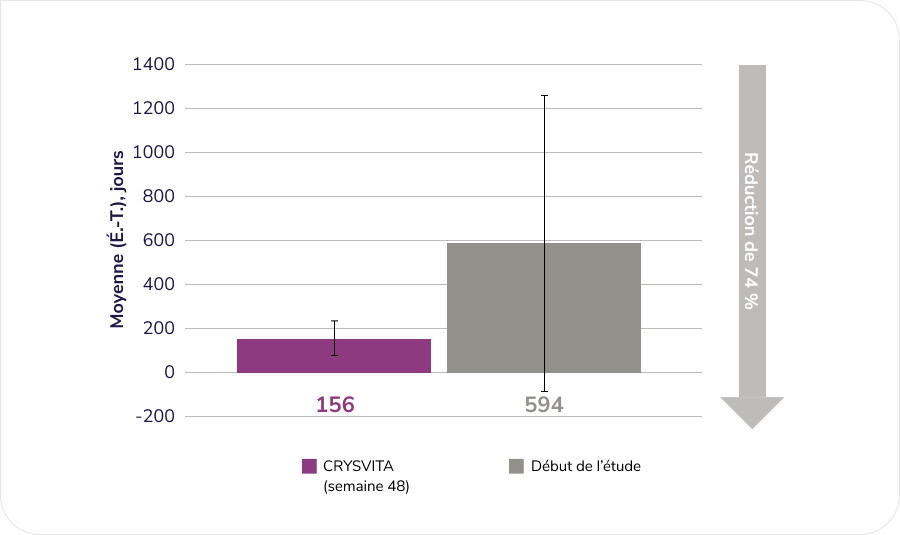
D’après la monographie du produit1.
ET = erreur type; É.-T. = écart-type; IC = intervalle de confiance; LIN = limite inférieure de la normale; MC = moindres carrés; WOMAC = Western Ontario and McMaster Universities Osteoarthritis Index (indice d’arthrose des universités Western Ontario et McMaster).
† La plage normale utilisée pour le phosphore sérique allait de 2,5 à 4,5 mg/dL (LIN = 2,5 mg/dL), avec un seuil de toxicité limitant la dose s’établissant à > 6,5 mg/dL1.
‡ Les taux de phosphate sérique ont été moyennés aux points médians de l’intervalle entre les doses pendant les 24 semaines de traitement1,2.
§ Étude de phase 3, à répartition aléatoire, en double aveugle et contrôlée par placebo chez 134 patients adultes atteints de XLH, avec prolongation en mode ouvert. Les patients ont été répartis aléatoirement pour recevoir soit le burosumab (CRYSVITA) par injection sous-cutanée de 1 mg/kg toutes les 4 semaines (n = 68), soit un placebo apparié par injection sous-cutanée toutes les 4 semaines (n = 66), suivi d’une période ouverte de 24 semaines au cours de laquelle les patients aléatoirement affectés au groupe placebo ont été transférés au groupe CRYSVITA; tous les patients sont demeurés en aveugle à leur attribution originale de traitement. Le phosphate oral et les analogues de vitamine D active étaient interdits pendant l’étude. Le paramètre d’évaluation principal était la proportion de patients atteignant une concentration moyenne de phosphore sérique supérieure à 2,5 mg/dL (LIN), selon la moyenne aux points médians des intervalles entre les doses, entre le début de l’étude et la semaine 241,2.
¶ Les IC de 95 % sont calculés en utilisant la méthode des scores de Wilson.
†† La valeurp a été calculée avec le test de Cochran-Mantel-Haenszel (CMH) pour l’association entre l’atteinte du critère d’évaluation principal et du groupe de traitement, en réglant pour les stratifications de répartition aléatoire1.
‡‡ 1 à 2 semaines après une dose3.
§§ Pourcentage selon les valeurs initiales.
¶¶ Étude ouverte de phase 3 à un seul groupe d’une durée de 48 semaines menée chez 14 patients adultes atteints de XLH. L’étude visait à évaluer les effets de CRYSVITA sur l’amélioration de l’ostéomalacie telle que déterminée par une évaluation histologique et histomorphométrique de biopsies osseuses de la crête iliaque. Les patients ont reçu 1 mg/kg de CRYSVITA toutes les quatre semaines. Le phosphate oral et les analogues de vitamine D active étaient interdits pendant l’étude. Sur les 14 patients admis à l’étude, 11 ont subi des biopsies osseuses appariées. Les données concernant le délai de minéralisation (MLt) ne sont présentées que pour 6 patients, comme une imputation a été nécessaire pour calculer les résultats de 5 patients en raison d’un important défaut de minéralisation1,5.
Références : 1. Monographie de CRYSVITA (injection de burosumab). Kyowa Kirin inc. 13 août 2025. 2. Insogna KL et coll. A randomized, double-blind, placebo-controlled, phase 3 trial evaluating the efficacy of burosumab, an anti-FGF23 antibody, in adults with X-linked hypophosphataemia: Week 24 primary analysis. J Bone Miner Res. 2018;33:1381–1382. 3. Portale AA et coll. Continued beneficial effects of burosumab in adults with Xlinked hypophosphataemia: Results from a 24week treatment continuation period after a 24week doubleblind placebocontrolled period. Calc Tiss Int. 2019;105:271–284. 4. ENDMEMO. En ligne : http://www.endmemo.com/medical/unitconvert/Phosphorus.php. Consulté le 3 octobre 2023. 5. Insogna KL et coll. Burosumab improved histomorphometric measures of osteomalacia in adults with X-Linked hypophosphatemia: A phase 3, single-arm, international trial. J Bone Miner Res. 2019;34(12):2183-2191.


